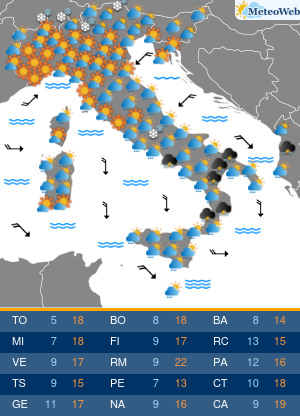
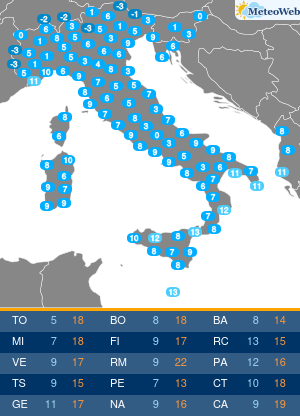
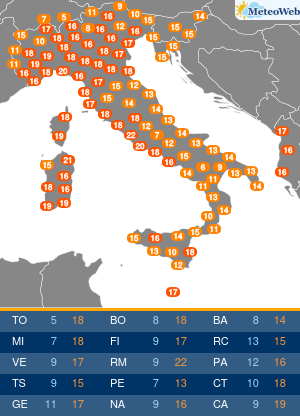
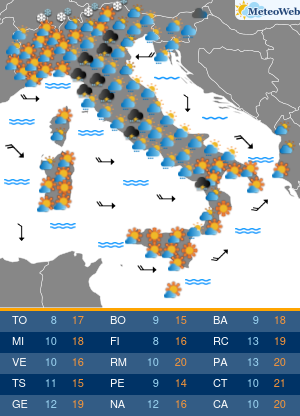
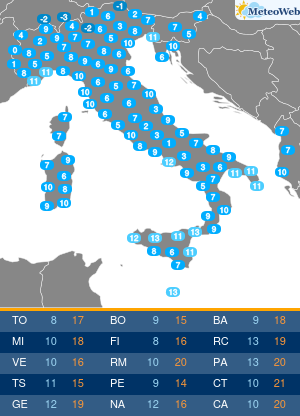
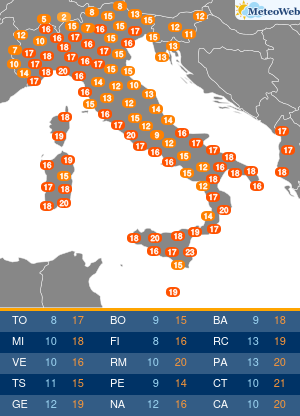
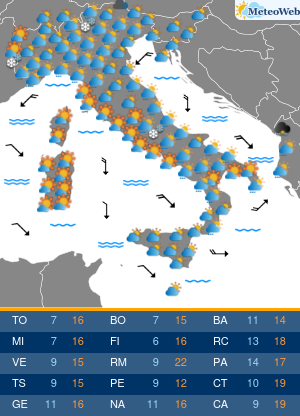
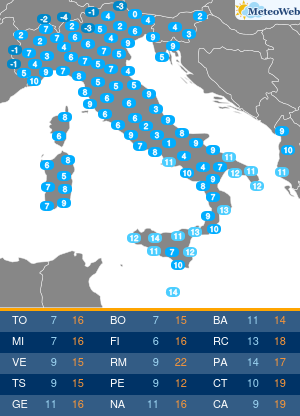
Utilizzando una strumentazione sviluppata dalla Universita’ di Parma e le nanotecnologie e’ stato possibile evidenziare il ruolo che alcune conformazioni normalmente instabili dell’emoglobina hanno negli equilibri di legame dell’ossigeno alla proteina. Sono frutto dell’attivita’ congiunta dei ricercatori emiliani e del National Institutes of Health di Bethesda (Usa) i risultati di un lavordell’Accademia delle Scienze degli Stati Uniti, Pnas. La ricerca sull’emoglobina (la proteina contenuta nei globuli rossi che lega l’ossigeno nei polmoni e lo trasporta ai tessuti) ha risolto infatti alcune incongruenze del modello che Monod, Wyman e Changeaux proposero nel 1965 per descrivere il legame dell’ossigeno all’emoglobina umana. Un modello che ha avuto conseguenze ampie nella descrizione del comportamento di proteine complesse, ma che tuttavia non e’ stato in grado di descrivere gli effetti che alcuni composti che si legano all’emoglobina hanno sull’affinita’ della proteina per l’ossigeno. Utilizzando appunto una strumentazione sviluppata appositamente nell’ateneo emiliano e un approccio nanotecnologico, e’ stato invece possibile per i ricercatori emiliani e americani evidenziare il ruolo che alcune conformazioni, normalmente instabili, dell’emoglobina hanno negli equilibri di legame dell’ossigeno alla proteina. I risultati ottenuti sull’emoglobina umana “hanno una valenza moto piu’ ampia e si applicano alla descrizione quantitativa della funzione di molte delle proteine complesse che negli organismi viventi regolano il metabolismo, come gli enzimi e i recettori” spiegano ora i ricercatori. La ricerca ha quindi anche potenziali ricadute in campo terapeutico, “suggerendo strategie per modulare le proprieta’ dell’emoglobina necessarie per trattare malattie quali l’anemia falciforme o potenziare l’efficacia di agenti antitumorali”.
Utilizzando una strumentazione sviluppata dalla Universita’ di Parma e le nanotecnologie e’ stato possibile evidenziare il ruolo che alcune conformazioni normalmente instabili dell’emoglobina hanno negli equilibri di legame dell’ossigeno alla proteina. Sono frutto dell’attivita’ congiunta dei ricercatori emiliani e del National Institutes of Health di Bethesda (Usa) i risultati di un lavordell’Accademia delle Scienze degli Stati Uniti, Pnas. La ricerca sull’emoglobina (la proteina contenuta nei globuli rossi che lega l’ossigeno nei polmoni e lo trasporta ai tessuti) ha risolto infatti alcune incongruenze del modello che Monod, Wyman e Changeaux proposero nel 1965 per descrivere il legame dell’ossigeno all’emoglobina umana. Un modello che ha avuto conseguenze ampie nella descrizione del comportamento di proteine complesse, ma che tuttavia non e’ stato in grado di descrivere gli effetti che alcuni composti che si legano all’emoglobina hanno sull’affinita’ della proteina per l’ossigeno. Utilizzando appunto una strumentazione sviluppata appositamente nell’ateneo emiliano e un approccio nanotecnologico, e’ stato invece possibile per i ricercatori emiliani e americani evidenziare il ruolo che alcune conformazioni, normalmente instabili, dell’emoglobina hanno negli equilibri di legame dell’ossigeno alla proteina. I risultati ottenuti sull’emoglobina umana “hanno una valenza moto piu’ ampia e si applicano alla descrizione quantitativa della funzione di molte delle proteine complesse che negli organismi viventi regolano il metabolismo, come gli enzimi e i recettori” spiegano ora i ricercatori. La ricerca ha quindi anche potenziali ricadute in campo terapeutico, “suggerendo strategie per modulare le proprieta’ dell’emoglobina necessarie per trattare malattie quali l’anemia falciforme o potenziare l’efficacia di agenti antitumorali”.
Medicina: svelato il ruolo della parti instabili dell’emoglobina