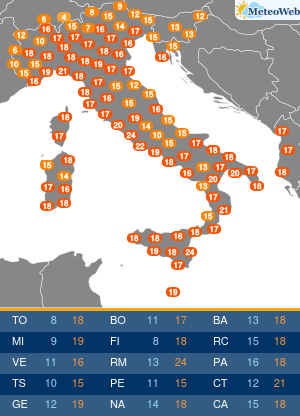
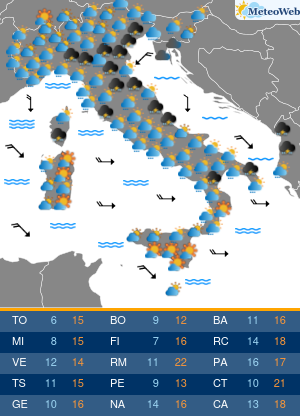
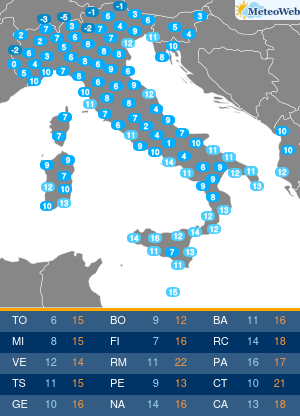
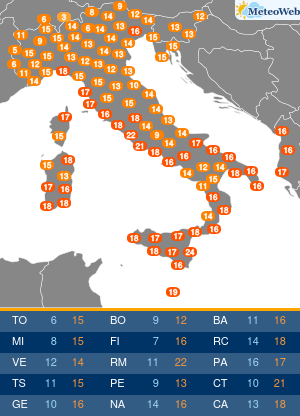
“Il contributo che i pazienti possono dare al processo di farmacovigilanza è prezioso nonché importantissimo per l’Ema. La loro prospettiva, essendo figlia di una esperienza diretta e di una personale conoscenza dell’ambiente terapeutico, apporta elementi che non possono essere appresi in nessun altro modo“. Lo spiega all’Adnkronos Salute il direttore esecutivo dell’Agenzia europea dei medicinali (Ema) Guido Rasi, illustrando le conclusioni di un progetto pilota per coinvolgere direttamente i pazienti nella valutazione dei rischi e benefici dei farmaci nel suo Committee for Medicinal Products for Human Use (Chmp). “Fin dalla sua costituzione – ricorda – l’Ema ha dimostrato di tenere in grandissima considerazione l’opinione dei pazienti, aumentando anno dopo anno le modalità con cui possono far pervenire le proprie opinioni all’Agenzia. Il coinvolgimento dei pazienti non avviene unicamente dopo che un farmaco ottiene la cosiddetta marketing authorisation, ma è caldeggiato da parte dell’Ema durante tutto il suo ciclo vitale, dalle prime fasi di sviluppo fino alla vigilanza una volta che viene immesso sul mercato. Basti pensare che nel solo 2016 i pazienti sono stati coinvolti in oltre 750 procedure. Particolarmente importante il contributo che i pazienti e le associazioni che li rappresentano possono fornire nel merito della farmacovigilanza. Per questo motivo i rappresentati dei pazienti sono membri attivi del comitato per la farmacovigilanza (Prac) dell’Ema, prendendo parte sia alle discussioni che alle decisioni prese dal comitato“. Inoltre, l’Agenzia consulta i pazienti durante i controlli di sicurezza così da poter comprendere il loro punto di vista. E “al momento della redazione delle comunicazioni di sicurezza per il pubblico il loro parere viene sempre tenuto in altissima considerazione – sottolinea Rasi – essendo fondamentale utilizzare un linguaggio semplice e preciso per poter far arrivare i nostri messaggi nella maniera più chiara possibile“. Non solo. “Dopo un percorso cominciato nel 2014, in cui sono stati coinvolti 22 stakeholder a rappresentanza di 25 organizzazioni, il Prac ha ufficialmente annunciato che in autunno si terrà il primo public hearing, il Comitato fisserà la data durante il suo prossimo incontro in giugno. Con questa iniziativa, e soprattutto grazie alle testimonianze dirette di pazienti, sarà possibile a tutti i membri del Prac entrare direttamente a contatto con prospettive, informazioni e opinioni a cui altrimenti non avrebbero potuto avere accesso“. E in Italia? “Da oramai molti anni l’Ema ha basato il suo modello di interazione con i pazienti sui principi di trasparenza, apertura e collaborazione. Un modello che, oltre ad essere uno dei più avanzati al mondo, si incentra sulla stretta collaborazione con organizzazioni presenti in tutto il territorio europeo; questo rende piuttosto complicato, se non impossibile, applicare il nostro modello ad organi nazionali come l’Aifa. Ed è proprio per questo motivo che gli organi nazionali hanno sviluppato metodologie alternative per interagire con i pazienti, potendosi d’altro canto concentrare sulle necessità peculiari che vi sono in ogni paese – continua Rasi – In questo contesto so che Aifa lavora sempre più a stretto contatto con la società civile e continua a sviluppare il suo modello per poter dare più spazio al contributo che i pazienti danno alla farmacovigilanza“. Rasi evidenzia come “anche all’interno dell’Ema il contributo dell’Aifa è cruciale, non solo grazie alle competenze che i membri dell’Agenzia italiana apportano, ma soprattuto per la continua voglia di innovare e trovare nuove soluzioni per aiutare i pazienti e migliorare i nostri, già altissimi, standard“. Tornando al progetto pilota targato Ema, il direttore sottolinea che i primi risultati “sono estremamente positivi e lo si è riscontrato fin dall’inizio dell’inclusione dei pazienti nel processo decisionale sulla valutazione del rapporto rischi-benefici che viene fatto su ogni farmaco. Anche da parte dei pazienti sono arrivati unicamente commenti positivi, derivanti a mio avviso dal fatto che l’Agenzia è riuscita a farli sentire parte integrante di un processo decisionale così complesso. Fra i vari benefici di questa iniziativa vi è pertanto l’aumento di fiducia dei pazienti nei confronti dell’Ema“. Il coinvolgimento dei pazienti continuerà? “L’impegno dell’Ema per coinvolgere i pazienti nella valutazione rischi-benefici di un farmaco, nonché in molte aree tematiche, è continuo e non vi è nessuna intenzione di mettervi fine – assicura Rasi – Continueremo inoltre a condividere le nostre impressioni sull’esperienza con la società civile per poter ricevere feedback ed impressioni“. Gli anni “ci hanno confermato come la presenza dei pazienti all’interno dell’Agenzia arricchisca la qualità del lavoro dell’Agenzia stessa. Portando inoltre ad una maggiore fiducia da parte dei pazienti nei confronti del nostro lavoro e favorendo lo sviluppo di un rapporto di rispetto reciproco fra organo regolatorio e fruitori finali“, conclude.
Farmaci, EMA: il contributo dei pazienti la “chiave” per la farmacovigilanza