Dopo un anno e mezzo di lotta contro la pandemia, ormai le vaccinazioni contro il coronavirus SARS-CoV-2 proseguono spedite in Italia e in quasi tutto il mondo. In questi mesi, la comunità scientifica si è concentrata sullo sviluppo dei vaccini, presentati come l’unica arma in grado di sconfiggere la pandemia, una sorta di soluzione a tutti i mali, nonostante molti esperti del settore chiedessero a gran voce anche l’impegno per sviluppare altre terapie.
Per la prima volta da un anno e mezzo, l’UE ha affermato chiaramente che i vaccini non risolveranno il problema della pandemia. È il primo dietrofront dell’UE dall’inizio della pandemia. Stella Kyriakides, commissario UE per la Salute, ha affermato che il virus non scomparirà e che serviranno cure e terapie per quei pazienti che potranno ancora ammalarsi.
Kyriakides ha annunciato il primo portafoglio di 5 terapie che potrebbero essere presto disponibili per il trattamento del Covid-19 in tutta l’Unione europea. “Oggi stiamo facendo il primo passo verso un ampio portafoglio di terapie per il trattamento del Covid-19“, ha dichiarato Kyriakides. “Mentre la vaccinazione sta progredendo a velocità crescente, il virus non scomparirà e i pazienti avranno bisogno di trattamenti sicuri ed efficaci per ridurre il carico di Covid-19. Il nostro obiettivo è chiaro, puntiamo a identificare più candidati all’avanguardia in fase di sviluppo e ad autorizzare almeno tre nuove terapie entro la fine dell’anno”, ha aggiunto.
 Quattro delle 5 terapie annunciate sono anticorpi monoclonali in fase di revisione continua da parte dell’Agenzia europea per i medicinali (EMA). Un altro è un immunosoppressore, che ha un’autorizzazione all’immissione in commercio che potrebbe essere estesa per includere il trattamento dei pazienti Covid. La Commissione ha spiegato che i cinque prodotti sono in una fase avanzata di sviluppo e hanno un alto potenziale per essere tra le tre nuove terapie a ricevere l’autorizzazione entro ottobre 2021, l’obiettivo fissato dalla Strategia dell’UE, a condizione che i dati finali ne dimostrino la sicurezza, la qualità e l’efficacia.
Quattro delle 5 terapie annunciate sono anticorpi monoclonali in fase di revisione continua da parte dell’Agenzia europea per i medicinali (EMA). Un altro è un immunosoppressore, che ha un’autorizzazione all’immissione in commercio che potrebbe essere estesa per includere il trattamento dei pazienti Covid. La Commissione ha spiegato che i cinque prodotti sono in una fase avanzata di sviluppo e hanno un alto potenziale per essere tra le tre nuove terapie a ricevere l’autorizzazione entro ottobre 2021, l’obiettivo fissato dalla Strategia dell’UE, a condizione che i dati finali ne dimostrino la sicurezza, la qualità e l’efficacia.
Annunciate alcune indicazioni per i farmaci esistenti: è in fase di valutazione la domanda di estensione dell’autorizzazione all’immissione in commercio dell’immunosoppressore baricitinib (medicinale che riduce l’attività del sistema immunitario) di Eli Lilly, per l’indicazione Covid-19; anticorpi monoclonali di nuova concezione in fase di revisione continua; combinazione di bamlanivimab ed etesevimab di Eli Lilly, in fase di revisione continua; combinazione di casirivimab e imdevimab di Regeneron Pharmaceuticals, Inc. e F. Hoffman-La Roche, Ltd, in fase di revisione continua; regdanivimab di Celltrion, in fase di revisione continua; sotrovimab di GlaxoSmithKline e Vir Biotechnology, Inc., in corso di revisione.
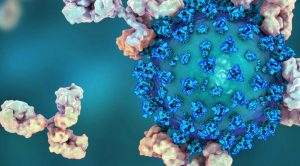 In Italia alcuni anticorpi monoclonali — bamlanivimab, il mix bamlanivimab-etesevimab e il mix casirivimab-imdevimab — sono stati autorizzati in via temporanea con decreto del Ministro della Salute lo scorso febbraio, per il trattamento di Covid da lieve a moderato in adulti e bambini.
In Italia alcuni anticorpi monoclonali — bamlanivimab, il mix bamlanivimab-etesevimab e il mix casirivimab-imdevimab — sono stati autorizzati in via temporanea con decreto del Ministro della Salute lo scorso febbraio, per il trattamento di Covid da lieve a moderato in adulti e bambini.
La Commissione ha spiegato che elaborerà un portafoglio di almeno 10 potenziali terapie per il Covid-19 entro ottobre, basandosi sul lavoro del nuovo gruppo di esperti sulle varianti del virus. Il processo di selezione sarà obiettivo e basato sulla scienza, con criteri di selezione concordati con gli Stati membri. Poiché sono necessari diversi tipi di prodotti per diverse popolazioni di pazienti e diversi stadi e gravità della malattia, il gruppo di esperti identificherà le categorie di prodotti e selezionerà i candidati terapeutici più promettenti per ciascuna categoria in base a criteri scientifici. Il portafoglio contribuirà all’obiettivo di avere almeno tre nuove terapie autorizzate entro ottobre ed eventualmente altre due entro la fine dell’anno. L’Agenzia europea per i medicinali avvierà ulteriori revisioni continue di terapie promettenti entro la fine del 2021, in base ai risultati della ricerca e dello sviluppo. La Commissione ha recentemente concluso un appalto congiunto di anticorpi monoclonali (casirivimab e imdevimab) e potrebbe avviarne altri entro la fine dell’anno.
Come funzionano gli anticorpi monoclonali
 Dal 10 marzo ad oggi, oltre 6.100 pazienti Covid hanno ricevuto anticorpi monoclonali in Italia, autorizzati in via emergenziale dall’Aifa. I monoclonali sono riservati a persone fragili, con infezione recente da SARS-CoV-2 e senza sintomi gravi. La maggior parte dei pazienti, in Italia, ha ricevuto la combinazione di bamlanivimab ed etesevimab di Eli Lilly. Ma come funzionano gli anticorpi monoclonali?
Dal 10 marzo ad oggi, oltre 6.100 pazienti Covid hanno ricevuto anticorpi monoclonali in Italia, autorizzati in via emergenziale dall’Aifa. I monoclonali sono riservati a persone fragili, con infezione recente da SARS-CoV-2 e senza sintomi gravi. La maggior parte dei pazienti, in Italia, ha ricevuto la combinazione di bamlanivimab ed etesevimab di Eli Lilly. Ma come funzionano gli anticorpi monoclonali?
“L’anticorpo monoclonale riconosce un solo “epitopo” (un piccolo gruppo di amminoacidi) del virus. Tutti i monoclonali hanno come obiettivo la proteina Spike: bloccandola, impediscono al virus di entrare nelle nostre cellule. Se il virus cambia spontaneamente la sequenza-target, il farmaco perde efficacia. Ecco perché spesso si usano associazioni di due anticorpi: la doppia mutazione è decisamente più improbabile”, spiega Giuseppe Nocentini, professore di Farmacologia all’Università di Perugia e membro della Società Italiana di Farmacologia.
Come detto, la combinazione di bamlanivimab ed etesevimab di Eli Lilly è stata quella ricevuta dalla maggior parte dei pazienti italiani ma negli ultimi giorni sono emersi dubbi sull’efficacia di tale mix contro alcune varianti. Negli Stati Uniti, l’Assistant secretary for preparedness and response (Aspr), ufficio che fa parte del Dipartimento della Salute, e la Food and drug administration (Fda), hanno sospeso fino a nuovo avviso la distribuzione della combinazione Eli Lilly e di etesevimab da solo, autorizzati in via emergenziale a febbraio. Alcuni test in vitro, infatti, hanno mostrato che gli anticorpi monoclonali di Eli Lilly non sono efficaci contro le varianti P.1 (identificate in Brasile) e la B.1.351 («sudafricana»). Gli stessi test hanno invece mostrato che la combinazione di monoclonali di Regeneron mantiene l’attività contro P.1 e B.1.351.
L’anticorpo Gsk
 Sotrovimab, di GlaxoSmithKline (Gsk) e Vir Biotechnology, è stato raccomandato il 27 maggio dall’EMA, come trattamento precoce per adulti e adolescenti (dai 12 anni in su e con peso non inferiore a 40 chili) con sintomi lievi, che non richiedono ossigeno e sono a rischio di avere forme gravi della malattia. Studi in vitro hanno dimostrato che sotrovimab è efficace contro diverse varianti. Sotrovimab ha, infatti, come bersaglio un “epitopo” della proteina Spike che ha meno probabilità di mutare nel tempo. Negli studi, sotrovimab ha mostrato di ridurre il rischio di morte dell’85% rispetto al placebo. Sulla base di questi risultati, è stato possibile interrompere l’arruolamento di pazienti, grazie alle evidenti prove di efficacia. La valutazione dell’EMA si è dunque conclusa, ma la procedura di revisione (rolling review), iniziata il 7 maggio, è ancora in corso. Una volta terminata, sarà possibile autorizzare la vendita in tutta l’Unione Europea.
Sotrovimab, di GlaxoSmithKline (Gsk) e Vir Biotechnology, è stato raccomandato il 27 maggio dall’EMA, come trattamento precoce per adulti e adolescenti (dai 12 anni in su e con peso non inferiore a 40 chili) con sintomi lievi, che non richiedono ossigeno e sono a rischio di avere forme gravi della malattia. Studi in vitro hanno dimostrato che sotrovimab è efficace contro diverse varianti. Sotrovimab ha, infatti, come bersaglio un “epitopo” della proteina Spike che ha meno probabilità di mutare nel tempo. Negli studi, sotrovimab ha mostrato di ridurre il rischio di morte dell’85% rispetto al placebo. Sulla base di questi risultati, è stato possibile interrompere l’arruolamento di pazienti, grazie alle evidenti prove di efficacia. La valutazione dell’EMA si è dunque conclusa, ma la procedura di revisione (rolling review), iniziata il 7 maggio, è ancora in corso. Una volta terminata, sarà possibile autorizzare la vendita in tutta l’Unione Europea.
L’anticorpo “italiano”
 Intanto anche l’Italia sta lavorando allo sviluppo di anticorpi monoclonali. Sono in corso le fasi 2/3 della sperimentazione clinica di «MAD0004J08», l’anticorpo monoclonale umano individuato dal Mad Lab, team di ricerca della Fondazione Toscana Life Sciences coordinato da Rino Rappuoli. Le fasi 2/3 coinvolgono 14 centri a Roma, Piacenza, Trieste, Pavia, Foggia, Siena, Vercelli, Verona, Milano, Parma, Pisa, Firenze, Napoli, Avellino. La terapia viene somministrata attraverso un’iniezione intramuscolo, “grazie all’estrema potenza di neutralizzazione mostrata finora nell’ambito di studi preclinici, che permette l’impiego di un dosaggio più basso rispetto ad altri trattamenti analoghi attualmente in uso”, spiegano i ricercatori. I test coinvolgono oltre 800 pazienti con infezione da SARS-CoV-2, risultati positivi al tampone da non più di 72 ore, asintomatici o moderatamente sintomatici. Dopo la somministrazione dell’anticorpo, i pazienti sono seguiti a casa e con visite periodiche in ospedale.
Intanto anche l’Italia sta lavorando allo sviluppo di anticorpi monoclonali. Sono in corso le fasi 2/3 della sperimentazione clinica di «MAD0004J08», l’anticorpo monoclonale umano individuato dal Mad Lab, team di ricerca della Fondazione Toscana Life Sciences coordinato da Rino Rappuoli. Le fasi 2/3 coinvolgono 14 centri a Roma, Piacenza, Trieste, Pavia, Foggia, Siena, Vercelli, Verona, Milano, Parma, Pisa, Firenze, Napoli, Avellino. La terapia viene somministrata attraverso un’iniezione intramuscolo, “grazie all’estrema potenza di neutralizzazione mostrata finora nell’ambito di studi preclinici, che permette l’impiego di un dosaggio più basso rispetto ad altri trattamenti analoghi attualmente in uso”, spiegano i ricercatori. I test coinvolgono oltre 800 pazienti con infezione da SARS-CoV-2, risultati positivi al tampone da non più di 72 ore, asintomatici o moderatamente sintomatici. Dopo la somministrazione dell’anticorpo, i pazienti sono seguiti a casa e con visite periodiche in ospedale.
Tocilizumab per i ricoverati
 Infine, c’è l’anticorpo monoclonale tocilizumab (di Genentech, filiale del gruppo svizzero Roche), già impiegato nella cura di malattie reumatiche e da tempo utilizzato in via sperimentale contro il Covid anche in Italia. Negli Stati Uniti, la Fda ha approvato in via emergenziale il suo utilizzo per il trattamento di Covid in adulti e bambini (dai 2 anni in su) ricoverati, in terapia con il cortisone e che necessitano di ossigeno, ventilazione meccanica o circolazione extracorporea. Tocilizumab fa scendere l’infiammazione, bloccando i recettori dell’interleuchina-6, una proteina prodotta dal sistema immunitario. Nelle sperimentazioni cliniche, aggiunto alla terapia di routine con cortisone, ha mostrato di ridurre il rischio di morte, il tempo trascorso in ospedale e la probabilità di essere sottoposti a ventilazione. Il 17 giugno anche l’Aifa ha inserito tocilizumab nell’elenco dei farmaci per il trattamento di adulti ricoverati con Covid grave o con livelli elevati degli indici di infiammazione.
Infine, c’è l’anticorpo monoclonale tocilizumab (di Genentech, filiale del gruppo svizzero Roche), già impiegato nella cura di malattie reumatiche e da tempo utilizzato in via sperimentale contro il Covid anche in Italia. Negli Stati Uniti, la Fda ha approvato in via emergenziale il suo utilizzo per il trattamento di Covid in adulti e bambini (dai 2 anni in su) ricoverati, in terapia con il cortisone e che necessitano di ossigeno, ventilazione meccanica o circolazione extracorporea. Tocilizumab fa scendere l’infiammazione, bloccando i recettori dell’interleuchina-6, una proteina prodotta dal sistema immunitario. Nelle sperimentazioni cliniche, aggiunto alla terapia di routine con cortisone, ha mostrato di ridurre il rischio di morte, il tempo trascorso in ospedale e la probabilità di essere sottoposti a ventilazione. Il 17 giugno anche l’Aifa ha inserito tocilizumab nell’elenco dei farmaci per il trattamento di adulti ricoverati con Covid grave o con livelli elevati degli indici di infiammazione.










